 Приведенные ниже простые опыты по химии связаны с изучением программного материала школьного курса химии.
Приведенные ниже простые опыты по химии связаны с изучением программного материала школьного курса химии.
Необходимо иметь батарейку для карманного фонаря, тонкую медную проволоку длиной 15—20 см с эмалированной изоляцией, стержни простых карандашей, активированный уголь в виде черных таблеток под названием «карболен» (продается в аптеках), по 1 г трех-четырех образцов удобрений, спринцовку и некоторые другие вещи, которые всегда найдутся дома. Какие вещества и оборудование необходимо брать для проведения опыта, видно из описания самих опытов, а также по рисункам.
1. Скорость реакции зависит от концентрации электролита
В две пробирки опустить кусочки яичной скорлупы, например по 6 штук, одинаковые по площади. В первую пробирку налить 0,5—1 мл уксусной кислоты, во вторую — столько же кислоты, но разбавленной в 5—6 раз водой. Вставить в пробирки газоотводные трубки, свободные концы которых опустить в банки с водой. Обе пробирки закрепить в держалках. Установить по числу выделяющихся пузырьков, в которой из пробирок скорость реакции большая. Этот опыт наглядно демонстрирует, что с уменьшением концентрации электролита — в данном случае при разбавлении водой кислоты — увеличивается число ионов (распавшихся молекул) и скорость реакции.
2. Гидролиз солей
В четыре флакона налить по 3—4 мл воды. В один добавить древесную золу (карбонат калия), в другой—3—4 капли силикатного клея (силикаты натрия и калия), в третий — крошки мыла (мыла—это соли высших жирных кислот), в четвертый — поваренную соль (хлорид натрия). Через 2—3 мин после растворения веществ растворы разлить на две части для испытания индикаторами — лакмусом и фенолфталеином. Хорошо, если школьник заполнит таблицу, указав в ней не только окраску индикатора (и, следовательно, сделав вывод о характере раствора — кислом или щелочном), но и уравнения гидролиза.
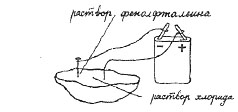
3. Электролиз раствора хлорида натрия
Присоединить провода к батарейке от карманного фонаря. Провод-анод (плюс) вставить в свежий срез клубня картофеля (среда, в которой распределяется раствор соли). Провод-катод (минус) с укрепленным на нем гвоздиком также вставить в срез картофеля (на расстоянии 1,5—2 см от первого электрода). На срез картофеля нанести 3—4 капли раствора поваренной соли. У гвоздика поместить измельченный кусочек пургена. В таком положении оставьте установку на 15—20 мин. Какие изменения происходят на срезе картофеля и чем их объяснить? (Точно так же можно провести опыт с электролизом раствора поваренной соли, взяв вместо клубня картофеля срез соленого огурца)
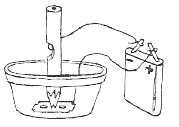
4. Электролиз раствора хлорида натрия с применением бумажной диафрагмы
В стаканчик налить раствор поваренной соли и разгородить сосуд бумажной перегородкой. Опустить в раствор стержни от карандаша — в разные отделения, верхние концы стержней соединить проводами с батарейкой. В катодное пространство опустить кусочек пургена (фенолфталеин) и наблюдать за происходящими изменениями. Как изменяется окраска жидкости в катодном пространстве? Какой газ выделяется на поверхности катода? Определить по запаху выделяющийся у анода газ.
5. Распознавание важнейших удобрений
Девятиклассники изучают пятую группу периодической системы элементов, подробно знакомясь с физическими и химическими свойствами азота и фосфора. Предлагаемые опыты не требуют каких-либо специальных реактивов. Практически для распознавания многих удобрений вполне достаточно воспользоваться лишь тлеющим угольком, стальным пером и пламенем.
Предполагается, что в трех бумажных пакетиках имеются образцы удобрений из следующих возможных: селитры (калийная, натриевая, кальциевая, аммиачная), сульфат аммония, карбамид, хлорид калия.
Ознакомиться с физическими свойствами образца удобрения (цвет, кристалличность, растворимость в воде и др.) и кратко описать их. В ходе анализа необходимо использовать бесцветное пламя горящего одеколона, газа, тлеющий уголек. (При анализе образца тлеющим угольком держать его — на стальном пере — над блюдцем или тарелкой с водой!) Появление плотного «дыма», плавление кристаллов и запах аммиака укажут на наличие карбамида.
Запах аммиака появляется и в случае, если мы имеем дело с кристаллами сульфата аммония или аммиачной селитры. Но кристаллы карбамида никогда не дают вспышек на тлеющем угольке, а кристаллы сульфата аммония и аммиачной селитры не образуют интенсивного (плотного) «дыма».
Для обнаружения в составе удобрения солей натрия, калия или кальция окраску пламени можно сделать более наглядной: на конец лучинки намотать немного ваты, смочить ее одеколоном, поджечь и в пламя внести несколько кристаллов исследуемого образца удобрения на кончике пера, вставленного в ручку. Окраску кальциевой селитры можно спутать с фиолетовой окраской соли калия. Чтобы различить их, надо сделать дополнительный анализ: отфильтровать приготовленный раствор золы (пользоваться им как раствором карбоната калия) и прилить к нему раствор исследуемого образца удобрения. Появление белого осадка укажет на кальциевую селитру. (Почему?)
В такой же последовательности провести анализ других образцов удобрений. Рекомендуем заполнить таблицу, в которой указать физические свойства вещества, окрашивание пламени, действие на тлеющий уголек, взаимодействие с раствором золы, сделанный вывод и формулу образца.
6. Как адсорбирует активированный уголь
В трубочку на тонкий рыхлый слой ваты поместить слой угля (растолочь таблетку карболена; если ее нет, можно воспользоваться измельченным древесным углем липы, березы), потом — тонкий слой промытого речного песка, чтобы уголь не всплывал. Закрепить трубочку в вертикальном положении с помощью проволочки. Для собирания жидкости, прошедшей через слой угля-адсорбента, можно воспользоваться флаконами, стаканами, а еще лучше узкой рюмкой. Капельницей в верхнюю часть трубочки налить 7—8 капель раствора чернил и наблюдать за тем, что происходит.
7. Адсорбция углем газов
Два одинаковых флакона (в один из них предварительно насыпать на дно уголь — 2—3 измельченных таблетки) заполнить оксидом углерода (IV). Его можно получить, например, действием уксусной эссенции на яичную скорлупу. Вставить во флаконы газоотводные трубки, наконечники которых опустить в банку с раствором чернил. Для большей устойчивости и удобства флаконы также опустить в стеклянные банки. Наблюдать за происходящими изменениями. В каком из наконечников раствор поднимается выше? Как это можно объяснить?
8. Адсорбционные свойства глины.
Приготовить (по 2 мл) растворы: чернил, перманганата калия и сок столовой свеклы. Поставить три флакона, поместить в них вертикально трубки и на маленький ватный тампон насыпать предварительно прокаленную и измельченную глину толщиной 1,5—2 см. Отфильтровать приготовленные растворы. Что получилось и почему?
9. Использование электролиза для «сверления» стального изделия.
Приготовить в блюдце насыщенный раствор поваренной соли. Соединить проводом лезвие безопасной бритвы с положительным полюсом батарейки. Это лезвие будет анодом. Заточить карандаш, обломить заточенный кончик стержня, но так, чтобы на этом конце карандаша получилось углубление 0,5—1 мм. На 1,5—2 см выше обнажить стержень и намотать на него провод, присоединенный к отрицательному полюсу батарейки. Таким образом, стержень карандаша будет катодом.
Положить лезвие в блюдце с раствором соли и коснуться карандашом-катодом лезвия. Чтобы карандаш устойчиво находился в таком положении, закрепить его. Необходимо помнить, что если стержень заостренного конца карандаша будет касаться металла, электролиз не произойдет. (Почему?)
Поставить установку на 20—30 мин и наблюдать за изменениями. Какой газ выделяется вокруг карандаша? Почему лезвие-анод в месте прикосновения карандаша будет растворяться и образуется отверстие? Как изменяется окраска жидкости в блюдце?
Из журнала “Семья и школа”


Отправляя сообщение, Вы разрешаете сбор и обработку персональных данных. Политика конфиденциальности.